■国内第Ⅰ/Ⅱ相臨床試験10)
10)承認時評価資料:国内第Ⅰ/Ⅱ相臨床試験(KDX1101)
紹介する結果には承認された用法及び用量外のデータが含まれますが、承認時評価資料のため掲載します。
目的
日本人のアントラサイクリン系抗悪性腫瘍剤の血管外漏出に対し、デクスラゾキサンを3日間連日静脈内投与したときの安全性、有効性及び薬物動態を検討した。
試験デザイン
多施設共同非盲検試験
対象
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者2例
方法
投与1日目(発生から6時間以内)及び2日目(初回投与開始24時間後)はデクスラゾキサン1000mg/m2を、3日目(初回投与開始48時間後)は500mg/m2を1日1回、90分かけて3日間連日静脈内投与した。
ただし、腎機能障害を伴う患者(eGFR 40mL/min/1.73m2未満)※では、曝露量が増加する可能性があるため、投与量を通常の半量とした。
評価項目
1)安全性(評価期間:4週間)
・有害事象の発現状況
・副作用の発現状況
・臨床検査(血液学的検査、血液生化学的検査、尿検査)
2)有効性(評価期間:12週間)
主要評価項目
・血管外漏出に対する外科的処置の有無
副次評価項目
・血管外漏出部位の症状
・血管外漏出に対する処置のためのがん治療スケジュールの遅延
3)薬物動態
・血漿中デクスラゾキサン濃度
※本試験の方法は国内で承認された用法及び用量と異なります。
国内で承認されている用法及び用量は次の通りです。
6. 用法及び用量(一部抜粋)
中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では投与量を通常の半量とする。
紹介した症例は臨床症例の一部を紹介したもので、全ての症例が同様な結果を示すわけではありません。
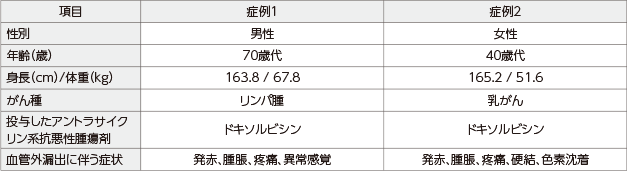

※ 腎機能低下が認められたため、デクスラゾキサンの投与量を通常の半量とした。

重症度はNCI-CTC規準(第4版)に基づき判定した。
※ 本試験において、重篤な有害事象として報告されている。
8. 重要な基本的注意(一部抜粋)
8.2 投与後は血管外漏出の症状が軽快するまで、定期的に漏出部位の状態を観察すること。
8.3 本剤は投与中及び投与終了後に骨髄抑制をおこすことがあるため、定期的に血液検査を行うなど、患者の状態を十分観察し、異常が認められた場合には適切な処置を行うこと。[11.1.1参照]