■海外第Ⅱ相臨床試験(海外データ)6)、7)
6)承認時評価資料:海外第Ⅱ相臨床試験(TT01)
7)添付文書改訂時評価資料:海外第Ⅱ相臨床試験(TT01)
目的
アントラサイクリン系抗悪性腫瘍剤の血管外漏出に対するデクスラゾキサンの有効性と安全性を検討した
試験デザイン
多施設共同非盲検試験
対象
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者23例
(有効性評価例数:蛍光法による組織生検で血管外漏出が確認された18例、安全性評価例数:23例)
方法
投与1日目(発生から6時間以内)及び2日目(初回投与開始24時間後)はデクスラゾキサン1000mg/m2を、3日目(初回投与開始48時間後)は500mg/m2を1日1回、1~2時間かけて3日間連日静脈内投与した。
評価項目
1)有効性(評価期間:90日)
主要評価項目
・血管外漏出に対する外科的処置
・壊死及び水疱の発現
副次評価項目
・血管外漏出部位の症状
・がん治療スケジュールの遅延
・血管外漏出のための入院
2)安全性(評価期間:28日)
・有害事象
・臨床検査
解析計画
血管外漏出に対する外科的処置率については、事前調査において蛍光法による組織生検でアントラサイクリン系抗悪性腫瘍剤の血管外漏出が確認された患者に対する外科的処置率(95%信頼区間)は100%(86〜100%)であったことから、外科的処置の発生率が20%を下回る場合に有効と評価した。p値は20%の帰無仮説に対しての片側直接確率法により算出した。
安全性は、有害事象(重篤な有害事象を含む)の発現状況及び臨床検査により評価した。有害事象の重症度は、NCI-CTC規準(第2.0版)に基づくグレード判定と因果関係を評価した。
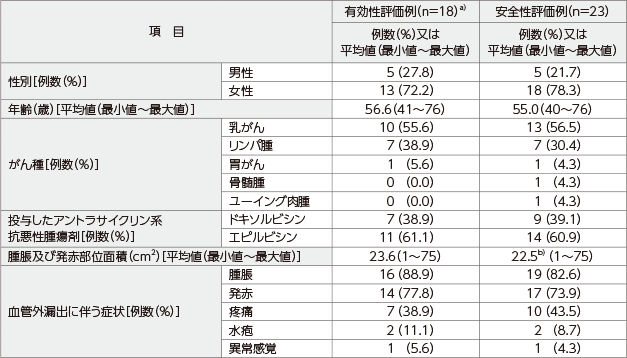
a) 除外された5例の内訳:
「生検で陰性」4例
「CVADによる血管外漏出で適切な生検の実施不能」1例
b) CVADによる血管外漏出で腫脹及び発赤が認められなかった1例を除く22例の平均値
CVAD:central venous access device(中心静脈アクセスデバイス)
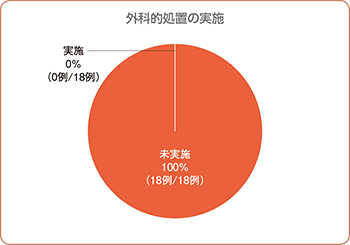
本剤投与後に外科的処置を実施した症例はなく、デクスラゾキサンの有効性が認められました(両側95%信頼区間:0~18.5%、p=0.018、片側直接確率法)。
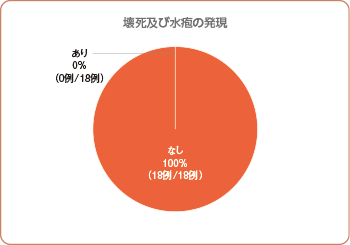
本剤投与後、壊死の発現は認められず、新たな水疱の発現もみられませんでした。
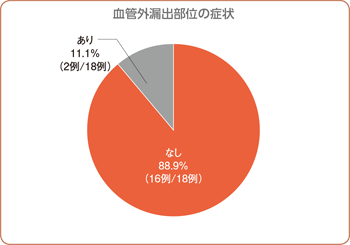
最終評価時において、18例中16例(88.9%)で血管外漏出部位の症状を認めませんでした。その他の2例に認められた血管外漏出部位の症状は、異常感覚2件、皮膚萎縮及び疼痛各1件でした。
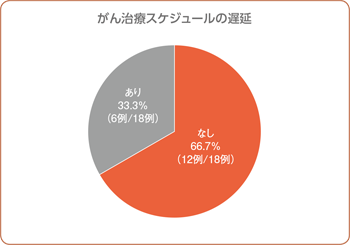
本剤投与後、18例中12例(66.7%)で計画された化学療法を遅延なく継続しました。6例に認められたスケジュールの遅延は平均8.7日(最小2日、最大24日)でした。
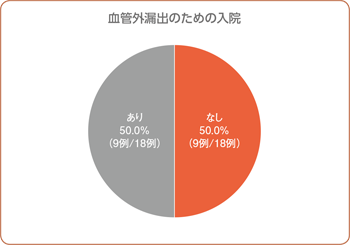
血管外漏出のための入院(副次評価項目)
本剤投与後、18例中9例(50.0%)で血管外漏出のための入院がありませんでした。入院が必要であった9例の入院期間は平均3.3日(最小1日、最大6日)でした。
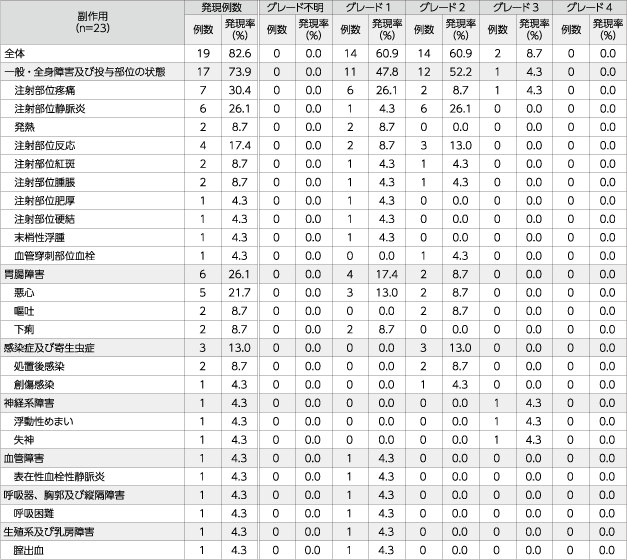
副作用の発現率は82.6%(19/23例)であり、主な副作用は注射部位疼痛30.4%(7/23例)、注射部位静脈炎26.1%(6/23例)、悪心21.7%(5/23例)、注射部位反応17.4%(4/23例)などでした。
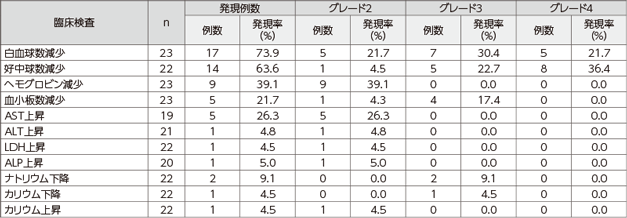
主な臨床検査値異常は白血球数減少73.9%(17/23例)、好中球数減少63.6%(14/22例)、ヘモグロビン減少39.1%(9/23例)、AST上昇26.3%(5/19例)、及び血小板数減少21.7%(5/23例)などでした。
また、重篤な有害事象は、発熱8.7%(2/23例)、汎血球減少症、好中球減少症、創傷感染、腫瘍進行、注射部位静脈炎、デクスラゾキサンの血管外漏出、肺炎、嘔吐、処置後感染、骨折、悪心、各4.3%(1/23例)でした。死亡は2例(原発性悪性腫瘍の進行2例)報告され、いずれも治療薬との因果関係は否定されました。
重症度はNCI-CTC規準(第2版)に基づき判定した。
同一症例においてグレードの異なる同一の副作用が認められた場合、それぞれのグレードで例数をカウントした。
<参考>NCI-CTC規準に基づくグレード判定
本剤の海外臨床試験では、有害事象、副作用の重症度はNCI-CTC規準(第2版)に基づきグレード判定が行われました。なお、日本語の項目名についてはMedDRA(Ver.15.0)を用いて再コード化を行いました。
NCI-CTC規準(第2版)に含まれていない有害事象は、該当する区分の"その他"の有害事象として、内容を具体的に記載した上で、以下の規準に従ってgradingしました。
グレード0:正常、正常/基準値範囲内、なし
グレード1:軽症/軽度の有害事象
グレード2:中等症/中等度の有害事象
グレード3:重症/高度の有害事象
グレード4:生命を脅かす又は活動不能にいたる有害事象
グレード5:有害事象による死亡(因果関係あり)
NCI-CTC:National cancer institute - common toxicity criteria(米国国立癌研究所 共通毒性規準)
8. 重要な基本的注意(一部抜粋)
8.2 投与後は血管外漏出の症状が軽快するまで、定期的に漏出部位の状態を観察すること。
8.3 本剤は投与中及び投与終了後に骨髄抑制をおこすことがあるため、定期的に血液検査を行うなど、患者の状態を十分観察し、異常が認められた場合には適切な処置を行うこと。[11.1.1参照]